Cục quản lý Dược, bộ y tế vừa có quyết định về việc thu hồi giấy đăng ký lưu hành thuốc tại Việt Nam đối với 5 thuốc.
Các loại thuốc này bao gồm: Thuốc Pompezo 40mg; hoạt chất, hàm lượng: Esomeprazol (dưới dạng vi hạt Esomeprazol magnesi dihydrat) 40mg; dạng bào chế: viên nang cứng; số đăng ký: VN-22822-21.
Thuốc Pompezo 20mg; hoạt chất, hàm lượng: Esomeprazol (dưới dạng vi hạt Esomeprazol magnesi dihydrat) 20mg; dạng bào chế: viên nang cứng; số đăng ký: VN-22821-21.
Thuốc Choludexan 300mg: Choludexan 300mg; hoạt chất, hàm lượng: Acid ursodeoxycholic 300mg; dạng bào chế: viên nang cứng; số đăng ký: VN-22820-21.
Thuốc Etacid 0,05%; hoạt chất, hàm lượng: mỗi liều xịt chứa: Mometason furoat 50mcg; dạng bào chế: hỗn dịch xịt mũi; số đăng ký: VN-22821-21.
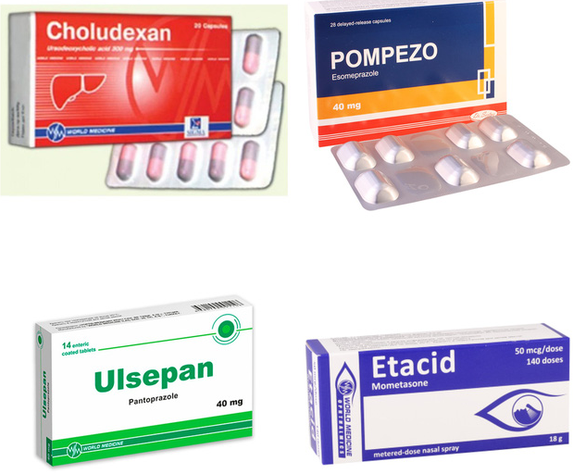
Các loại thuốc bị thu hồi giấy đăng ký lưu hành tại Việt Nam vì giả mạo hồ sơ - Ảnh: cục quản lý dược
Cả 4 loại thuốc trên đều do công ty cổ phần Dược phẩm Minh Kỳ (địa chỉ số 1-3, Lô C, Cư xá Lạc Long Quân, P.5, Q.11, TP. HCM - Việt Nam) đăng ký; do World Medicine Ilac San. ve Tic. A.S. (địa chỉ 15 Temmuz Mah. Cami Yolu Cad. No 50, Güneşli, Bagcilar/ Istanbul – Turkey) sản xuất.
Loại thuốc còn lại bị thu hồi giấy đăng ký lưu hành thuốc là Ulsepan 40mg; hoạt chất, hàm lượng: Pantoprazole (dạng Pantoprazole natri sesquihydrate) 40mg; dạng bào chế: viên nén bao tan trong ruột; số đăng ký: VN-22123-19.
Thuốc do công ty TNHH MTV DP Altus (địa chỉ số 49, đường 79, Phường Tân Quy, Quận 7, TP. HCM - Việt Nam) đăng ký; do World Medicine Ilac San. ve Tic. A.S. (địa chỉ 15 Temmuz Mah. Cami Yolu Cad. No 50, Güneşli, Bagcilar/ Istanbul – Turkey) sản xuất.
Các loại thuốc nêu trên bị thu hồi giấy đăng ký lưu hành thuốc tại Việt Nam do vi phạm Điểm d, Khoản 1 Điều 58 Luật Dược: Giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc được cấp dựa trên hồ sơ giả mạo.
Trong thời hạn không quá 30 ngày kể từ ngày có kết luận bằng văn bản của cơ quan quản lý có thẩm quyền về việc hồ sơ của thuốc đã được cấp giấy đăng ký lưu hành là hồ sơ giả mạo hoặc thuốc, nguyên liệu làm thuốc được sản xuất không đúng địa chỉ theo hồ sơ đăng ký, cục quản lý Dược ra quyết định thu hồi giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc. (Theo Khoản 5 Điều 42 Thông tư số 32/2018/TT-BYT).
Căn cứ Quyết định trên, cục quản lý Dược yêu cầu các cơ sở đăng ký thuốc, nhập khẩu thuốc phối hợp với cơ sở sản xuất thuốc thông báo thu hồi tới các cơ sở bán buôn, bán lẻ, sử dụng thuốc, tiến hành thu hồi toàn bộ các mặt hàng thuốc nêu trên, gửi báo cáo thu hồi về cục quản lý Dược trước ngày 15/06/2022.