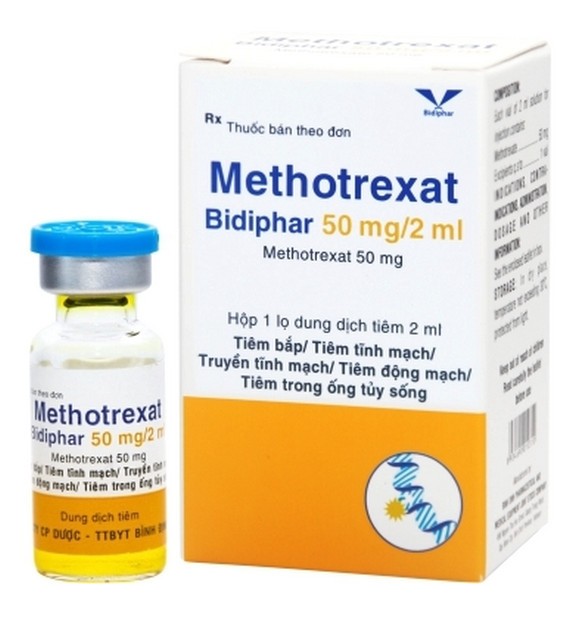
Theo quyết định số 483/QĐ-XPHC ngày 7/7/2023 của cục Quản lý Dược - Bộ Y tế, công ty cổ phần Dược - Trang thiết bị y tế Bình Định Bidiphar đã thực hiện hành vi sản xuất thuốc vi phạm chất lượng mức độ 1 theo quy định của pháp luật đối với thuốc Methotrexat Bidiphar 50mg/2ml (số giấy đăng ký lưu hành QLĐB-638-17, số lô 21003, ngày sản xuất 30/8/2021, hạn dùng 30/8/2023).
Với hành vi vi phạm trên, Bidiphar bị xử phạt hành chính với số tiền là 100 triệu đồng.
Cùng với đó, dây chuyền sản xuất thuốc tiêm độc tế bào của Bidiphar sẽ bị đình chỉ hoạt động trong 2 tháng kể từ ngày ban hành quyết định.
Đồng thời, toàn bộ lô thuốc Methotrexat Bidiphar 50mg/2ml (số giấy đăng ký lưu hành QLĐB-638-17, số lô 21003 ngày sản xuất 30/8/2021, hạn dùng 30/8/2023) vi phạm chất lượng sẽ bị buộc tiêu huỷ. Công ty cổ phần Dược - Trang thiết bị y tế Bình Định Bidiphar phải gửi báo cáo về việc thu hồi và thực hiện biện pháp khắc phục hậu quả cho cục Quản lý Dược trong vòng 30 ngày kể từ ngày ban hành quyết định này.
Bà Phạm Thị Thanh Hương hiện giữ chức vụ tổng Giám đốc công ty. Bidiphar có trụ sở chính tại số 498 đường Nguyễn Thái Học, phường Quang Trung, thành phố Quy Nhơn, tỉnh Bình Định.
Được biết, dung dịch tiêm Methotrexat Bidiphar 50mg/2ml là thuốc điều trị bệnh ung thư của Bidiphar. Methotrexat Bidiphar 50mg/2ml dùng cho người ung thư lá nuôi, bệnh bạch cầu, ung thư vú, ung thư phổi, ung thư đầu và cổ.
Trước đó, vào tháng 12/2021 thuốc này cũng đã từng bị “tuýt còi” với mẫu trên dung dịch tiêm Methotrexat Bidiphar 50mg/2ml (Methotrexat 50mg/2ml), có số GĐKLH: QLĐB-638-17, số lô: 21003; ngày SX: 30/8/2021; HD: 30/8/2023 do Công ty cổ phần Dược - Trang thiết bị Y tế Bình Định (Bidiphar) sản xuất.
Theo đó, mẫu thuốc được Trung tâm kiểm nghiệm thuốc, mỹ phẩm, thực phẩm TP.Hà Nội lấy tại Khoa dược, Bệnh viện Nhi Trung ương. Mẫu thuốc trên không đạt tiêu chuẩn chất lượng về chỉ tiêu nội độc tố vi khuẩn và độ vô khuẩn.
Ngày 3/12/2021, cục Quản lý Dược nhận được văn thư của bệnh viện Nhi Trung ương về việc phát hiện một số dấu hiệu bất thường trên bệnh nhân sau khi sử dụng thuốc.
Để đảm bảo chất lượng thuốc, an toàn cho người sử dụng, cục Quản lý Dược thông báo thu hồi toàn quốc thuốc dung dịch tiêm Methotrexat Bidiphar 50mg/2ml với lô trên.
Thạch Thảo














